Op deze pagina wordt gekeken hoe effectief kooldioxide is als broeikasgas: hoeveel warmtestraling kan kooldioxide eigenlijk teruggeven aan de Aarde, oftewel welke infraroodgebieden kunnen door kooldioxide worden geabsorbeerd? Ik ben natuurlijk geen weerkundige, noch chemicus of natuurkundige. Mocht je fouten tegenkomen dan hoor ik dat graag.
Waterdamp wint het qua hoeveelheid moleculen indrukwekkend ten opzichte van kooldioxide in de atmosfeer bij normale vochtigheid. Maar hoe zit het qua absorptie van infraroodlicht door kooldioxide en waterdamp?
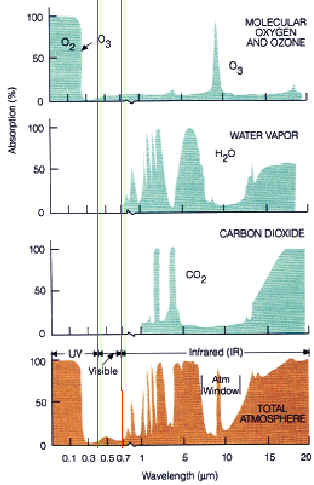
Op het plaatje bovenin kun je het volgende zien: op de horizontale as staat de golflengte van de straling die oftewel van de zon of van de aarde komt. Op de verticale as staat het percentage dat geabsorbeerd wordt door een bepaald gas. Vervolgens zie je vier grafiekjes: de bovenste geeft weer wat ozon uit het infrarood opneemt (vooral rond de 10 micrometer), vervolgens wat waterdamp opneemt, wat kooldioxide opneemt en onderin in het bruin zie je optelling van al deze gassen. Die 'optelling' geeft een mooi overzicht van alles wat door de gassen gezamelijk wordt geabsorbeerd.
Zoals je kunt zien zie je twee pieken in de kooldioxide opname rond 2,7 micrometer en 4,3 micrometer en vanaf de 13 micrometer. Waterdamp omvat een ruimer bereik, namelijk van 0,7 tot 7 (met een gat in het deel dat mooi door kooldioxide wordt opgevuld rond de 4,3 micrometer) en ook vanaf 13 micrometer.
Uit deze grafiek blijkt dat waterdamp in staat is om beduidend meer infraroodfrequenties te kunnen absorberen dan kooldioxide dat kan. Kooldioxide kan echter ook een bepaalde frequentie absorberen (4,3 micrometer), iets waartoe waterdamp weer niet in staat is.
Opmerkelijk is verder dat de huidige hoeveelheid kooldioxide in de lucht al nagenoeg al het infrarood in haar frequentiegebied zou opnemen. Dit verschijnsel wordt 'verzadiging' genoemd. Met andere woorden, indien er meer kooldioxide in de atmosfeer zou komen, kan er nauwelijks nóg meer warmte worden opgenomen, want er is niet 'meer' infraroodlicht van de voor kooldioxide gepaste frequentie aanwezig. Het zou dan volgens deze benadering ook niet veel warmer kunnen worden als er meer kooldioxide in de atmosfeer zou komen. (zie 'Climate Change').
Ook binnen deze verzadigingstheorie zijn weer andere invalshoeken die wel degelijk beweren dat er nog meer warmte kan worden opgenomen door kooldioxide omdat de band dikker zou worden. Dit wordt dan ook nader uitgewerkt in een nog te ontwikkelen pagina op deze site.
Aanvulling door H.O. van der Kooi, academisch chemicus in oktober 2008. Ik ben er nog niet aan toegekomen om me verder te bekwamen in de terminologie die gebezigd wordt. Dit is voor de werkelijk geïnteresseerden. Aanvullende informatie blijft echter gewenst.
Enig commentaar op de IR-absorpties door CO2.
CO2 kent drie vibratie vrijheden: symmetrische rekvibratie, asymmetrische rekvibratie en twee gedegenereerde buigvibraties ( is er dus eigenlijk maar één). De eerste is niet infrarood actief.
In de verschillende teksten wordt deze echter wel beschouwd als mogelijkheid om energie te absorberen. De hoogste energie absorptie vindt plaats bij ca. 2325 cm-1 (is 4,3 micrometer) de band bij 13 micrometer heeft maar een fractie van de intensiteit van de 4,3 micrometer piek. Deze absorptie hoort bij de asymmetrische rekvibratie. Er wordt dus uit het hele IR gebied in de zwartlichaam straling van de aarde als gevolg van de opwarming door de zon maar een heel klein frequentie gebiedje geabsorbeerd.
Deze absorptie leidt nog niet meteen tot een temperatuursverhoging van de atmosfeer. Hiervoor moet de vibratie-energie in de aangeslagen toestand van CO2 omgezet worden in kinetische energie van de moleculen in de atmosfeer. Hier doet zich de vraag voor hoeveel moleculen CO2 in de aangeslagen toestand de kans krijgen dit opgenomen energie- pakketje, volgens de quantummechanica kan niet een gedeelte van de opgenomen energie worden overgedragen, door een juiste botsing over te dragen op bijv. O2, N2, H2O of een ander CO2 molecuul dat nog in de grondtoestand verkeerd, voordat het aangeslagen CO2 spontaan zijn energie pakketje uitstraalt als dezelfde IR-straling die het heeft opgenomen.
Deze relaxatie kan wel gemeten worden maar het is mij niet bekend in welke tijd alle CO2 in de aangeslagen toestand terug gekeerd zijn in de grondtoestand. Misschien dat een collega-chemicus hierop een antwoord kan geven. De botsingsprocessen zijn onderhevig aan de statische processen.
Deze maken gebruik van kansen dat juiste botsingen leiden tot omzetting van IR-energie in kinetische energie. Ook op dit terrein ben ik geen specialist. De kinetische energie van deeltjes zijn een functie van de temperatuur met als evenredigheidsconstante k (Boltzman constante).
Om precies te bereken hoeveel de temperatuurstijging van de atmosfeer het gevolg is van de absorptie van IR-straling moet worden onderzocht hoeveel CO2 moleculen in de onder 10 meter van de atmosfeer (bijna volledig absorptie van de 43, micrometer straling vindt hierbij plaats) in welke tijd hun extra vibratie-energie kwijt raken door effectieve botsingen. Als we dit weten kunnen we via de relatie E = hv (v (Griekse letter nu) is de frequentie, h de constante van Planck) en E = ½ mv2 precies de temperatuurstijging bereken t.g.v. de opname van energie door CO2.
Met vriendelijke groet,
H.O. van der Kooi